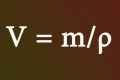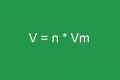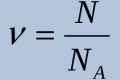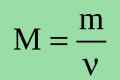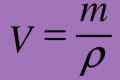Як змінюється тиск ідеального газу?

Ідеальний газ являє собою фізичну модель газу. Ця модель практично не враховує взаємодію молекул між собою. Вона використовується для опису поведінки газів з математичної точки зору. Дана модель передбачає наступні властивості газу:
- розмір молекул більше, ніж відстань між молекулами;
- молекули являють собою круглий кулі;
- відштовхуються молекули один від одного і від стінок посудини тільки після зіткнення. Зіткнення абсолютно пружні;
- рухаються молекули відповідно до законів Ньютона.
Існує кілька видів ідеального газу:
- класичний;
- квантовий (розглядає ідеальний газ в умовах зниження температури і збільшення відстані між молекулами);
- в гравітаційному полі (розглядає зміни властивостей ідеального газу в гравітаційному полі).
Нижче буде розглянуто класичний ідеальний газ.
Як визначити тиск ідеального газу?
Фундаментальна залежність всіх ідеальних газів виражається за допомогою рівняння Менделєєва-Клапейрона.
PV = (m / M)•RT [Формула 1]
де:
- P - тиск. Одиниця виміру - Па (Паскаль)
- R = 8,314 - універсальна газова постійна. Одиниця виміру - (Дж / моль•К)
- T - температура
- V - об`єм
- m - маса газу
- M - молярна маса газу. Одиниця виміру - (г / моль).
P = nkT [Формула 2]
Формула 2 показує, що тиск ідеального газу залежить від концентрації молекул і температури. Якщо врахувати особливості ідеального газу, то n буде визначаться формулою:
n = mNа / MV [Формула 3]
де:
- N - число молекул в посудині
- Nа - постійна Авогадро
Підставивши формулу 3 в формулу 2, отримуємо:
- PV = (m / M) Nа kT [Формула 4]
- k * Nа = R [Формула 5]
Постійна R є константою для одного благаючи газу в рівність Менделєєва-Клапейрона (згадаймо: при постійному тиску і температурі 1 моль різних газів займає однаковий об`єм).
Тепер виведемо рівняння тиску для ідеального газу
m / M = nu- [Формула 6]
- де nu- - кількості речовини. Одиниця виміру - моль
Отримуємо рівняння тиску ідеального газу, формула приведена нижче:
P = nu-RT / V [Формула 7]
- де P - тиск. Одиниця виміру - Па (Паскаль)
- R = 8,314 - універсальна газова постійна. Одиниця виміру - (Дж / моль•К)
- T - температура
- V - об`єм.
Як зміниться тиск ідеального газу?
Проаналізувавши рівність 7, можна побачити, що тиск ідеального газу пропорційно зміні температури і концентрації.
У стані ідеального газу можливі зміни всіх параметрів, від яких він залежить, а можливі зміни і деяких з них. Розглянемо найбільш ймовірні ситуації:
- Ізотермічний процес. Цей процес характеризується тим, що температура в ньому буде постійна (T = const). Якщо в рівняння 1 підставити постійну температуру, то побачимо, що значення твори P * V теж буде постійним.
- PV = const [Формула 8]
Рівність 8 показує залежність між обсягом газу і його тиском при постійній температурі. Це рівняння було в 17 столітті відкрито експериментальним шляхом фізиками Робертом Бойл і Едмом Маріоттом. Рівняння назвали в їх честь законом Бойля-Маріотта.
- Ізохорний процес. У цьому процесі незмінним залишається обсяг, маса газу і його молярна маса. V = const, m = const, M = const. Таким чином, отримуємо тиску ідеального газу. Формула показана нижче:
- P = P0AT [Формула 9]
- Де: P - тиск газу при абсолютній температурі,
- P0 - тиск газу при температурі 273 ° K (0 ° C),
- A - температурний коефіцієнт тиску. A = (1 / 273,15) До-1
Ця залежність була відкрита в 19 столітті експериментальним шляхом фізиком Шарлем. Тому рівняння і носить назву свого творця - закон Шарля.
Ізохорний процес можна спостерігати, якщо при постійному обсязі нагрівати газ.
- Ізобарний процес. Для цього процесу постійними будуть тиск, маса газу і його молярна маса. P = const, m = const, M = const. Рівняння ізобарного процесу має вигляд:
- V / T = const або V = V0AT [Формула 10]
- де: V0 - обсяг газу при температурі 273 ° K (0 ° C);
- A = (1 / 273,15) До-1.
У цій формулі коефіцієнт А виступає температурним коефіцієнтом для об`ємного розширення газу.
Ця залежність була відкрита в 19 столітті фізиком Жозефом Люссаком. Саме тому це рівність носить його ім`я - закон Гай-Люссака.
Якщо взяти скляну колбу, з`єднану з трубкою, отвір якої буде закрито рідиною, і нагрівати конструкцію, то можна буде спостерігати ізобарний процес.
Варто відзначити, що повітря при кімнатній температурі має властивості, схожі з ідеальним газом.