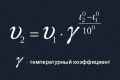Як прискорити реакцію?

Сьогодні життя людини, як, втім, і життя його далеких предків, безпосередньо пов`язана з різними обставинами і факторами. Основними для нього є реакції фізичного і хімічного порядку. Без них світ перетворився б в статичну субстанцію, неспроможну до якого-небудь розвитку і руху, до зародження живого організму і його еволюції. Людина вже досить багато знає про природу речовин. Йому відомо, як влаштовані речовини, в які реакції вступають, а також про те, як прискорити реакцію їх взаємодії, щоб швидше отримати результат.
Поняття «Хімічна реакція»
Під цим словосполученням розуміють взаємодію кількох речовин, які називаються реагентами, результатом його стає речовина абсолютно нової якості. Іншими словами, при реакціях такого порядку з одних речовин, за допомогою розриву одних зв`язків і утворення зв`язків абсолютно нових, утворюються і нові речовини. Хімічні реакції часто плутають з реакціями ядерними, це неправильно, оскільки при ядерних реакціях відбувається не створення нової речовини, а перетворення вихідного - в речовина іншого порядку.
За типом отриманих речовин хімічні реакції класифікують на реакції:
- розкладання,
- окислення,
- з`єднання,
- одинарного і подвійного заміщення,
- окислювально-відновні.
Кожну описує конкретне хімічне рівняння. Взаємодіють речовини між собою в результаті змішування або фізичного контакту. Процеси ці можуть протікати по-різному, розглядають різні типи протікання хімічних реакцій.
- Мимовільна реакція.
- Термічні (вплив високою температурою).
- Каталозі (за участю каталізатора).
- Фотохімічні (під впливом світла).
- Електродні (вплив електричними зарядами).
- Радіаційно-хімічні (вплив іонізуючим випромінюванням).
- МЕХАНОХІМІЧНО (механічний вплив).
- Плазмохімічні (на низькотемпературної плазмі).
Хімічні реакції: основні види
За кількістю речовин, що вступають в реакції, їх поділяють на дві базові групи:
Складні хімічні реакції
- Реагенти (вихідні речовини).
- Продукти реакції (ті речовини, що є результатом реакції).
- Каталізатор реакції (речовину, що прискорює хімічну реакцію називається її каталізатором).
Прості хімічні реакції
- Реагенти (вихідні речовини).
- Продукти реакції (ті речовини, що отримані в результаті хімічної реакції).
Людина давно навчився прискорювати реакції взаємодії речовин. Наприклад, кожному відомо, що цукор швидше розчинитися в чашці з гарячим кавовим напоєм, ніж в охолодженому кави. Реакцію розчинення (цукру в кавовому напої) прискорили під впливом підвищеної температури реагенту (гаряча кава). Саму цю реакцію можна віднести до термічного типу.
Прискорення хімічної реакції
Взаємодіючи на молекулярному рівні, все речовини беруть участь в різних хімічних реакціях, останні можуть по-різному протікати в часі. Одні - швидше, інші - повільно або майже непомітно для очей людини. Як прискорити реакцію взаємодії речовин між собою?
Розглянемо інший приклад: якщо спробувати підпалити цукор рафінад, можна побачити, що при сильному нагріванні відбувається його плавлення з утворенням карамелі коричневого кольору і характерного їй запаху. При цьому цукор не загоряється. Спалити його можна, якщо використовувати додаткове речовина - тютюновий попіл. Досить обсипати шматочок цукру цим попелом і внести у відкритий вогонь, він тут же загориться.
В останньому прикладі потрібну хімічну реакцію провели з використанням спеціальної речовини. Всі хімічні реакції, які не бажають протікати самостійно або йдуть в дуже повільному темпі, можна прискорити за допомогою своєрідного «стимулу». Отже, речовину, що прискорює хімічну реакцію, називається каталізатором, а сама хімічна реакція - катализом.
Поняття «каталізу» і його види
Каталізатором може виступати інше хімічна речовина, що сприяє прискоренню конкретної реакції. До речі, кількість каталізатора після завершення реакції не змінюється, що не властиво реагентів. Іншими словами, каталізатор не приймає участі в такій реакції, його не можна вважати реагентом, він лише допомагає їм вступати в реакцію, прискорюючи швидкість їх взаємодії. Ніколи не можна плутати каталізатори з ініціаторами, оскільки останні в ході перебігу реакції витрачаються.
Молекули можуть взаємодіяти з циклу, при наявності достатньої кількості реагенту. Активна позиція в цих реакція належить іонів, радикалам і координаційно-насиченим з`єднанням. Ступінь концентрації активних частинок, різниця між енергією утвореною зв`язку і розривається, визначають швидкість течії хімічної реакції.
Під катализом увазі процес, що впливає на швидкість течії реакції, за участю активних речовин, званих каталізаторами. Принцип його дії простий: каталізатор прискорює хімічну реакцію завдяки тому, що реагуючи з реагентом, сприяє швидкому утворенню проміжного з`єднання. Під впливом ряду перетворень, відбувається розщеплення цього з`єднання. На виході отримуємо продукт реакції і каталізатор, готовий знову вступати в аналогічну реакцію з реагентом (з циклу).
види каталізу
Сутність процесів каталізу можна вважати однаковою, що базується на освіті низки проміжних сполук каталізатора і реагенту. Формально все хімічні процеси, пов`язані з катализом, поділяють на три види:
гомогенний
Цей процес має на увазі утворення однієї спільної фази між каталізатором і реагентами. Найбільш часто це рідина або газоподібна речовина.
мікрогетерогенний
Даний вид каталізу здійснюється в рідкій фазі за участю різноманітних колоїдних частинок, які виступають в ролі каталізаторів. Наприклад, при ферментному каталізі, що протікає в клітинах рослинного і тваринного походження, каталізаторами біологічного порядку є білки прискорюють реакції - це звичайні ферменти. Для таких реакцій характерна висока ступінь селективності, без них неможливе життя для будь-якого організму.
гетерогенний
При взаємодії реагентів і каталізатора утворюються різні фази, а сама каталітична реакція протікає на розділяє їх кордоні. У подібних реакціях каталізаторами є тверді речовини, а реагентами - рідини або гази.
Існують такі поняття, як каталіз негативний (уповільнення реакції під впливом «антикаталізатором» - інгібітори) і позитивний (прискорення реакції каталізатором).
Теорію каталітичних процесів простий назвати не можна, вона досить складна і відноситься до маловивчених областей сучасної науки. Сьогодні вивчається кілька теорій щодо механізмів дії каталізаторів. Найбільш прийнятною в фізичної хімії вважають теорію проміжних сполук.